主要成分
本品为复方制剂,主要成份为替加氟、吉美嘧啶、奥替拉西钾。
用法用量
替吉奥胶囊联合顺铂用于治疗不能切除的局部晚期或转移性胃癌患者:
一般情况下,根据体表面积按照下表决定成人的首次剂量。用法为每日2次、早晚餐后口服,连续给药28天,休息14天,为一个治疗周期。给药直至患者病情恶化或无法耐受为止。
体表面积(m2)
首次剂量(按替加氟计)
<1.25
每次40mg
1.25-<1.5
每次50mg
1.5
每次60mg
可根据患者情况增减给药量。每次给药量按40mg、50mg、60mg、75mg四个剂量等级顺序递增或递减。若未见本药所导致的实验室检查(血常规、肝肾功能)异常和胃肠道症状等安全性问题,且医师判断有必要增量时,则可按照上述顺序增加一个剂量等级,上限为75mg/次。如需减量,则按照剂量等级递减,卜限为40mg/次。连续口服21天、休息14天,给药第8天静脉滴注顺铂60mg/m2,为一个治疗周期。给药直至患者病情恶化或无法耐受为止。
用法用量的注意事项:
可根据患者情况,参照下述标准增减给药量,每个周期内增量不得超过一个剂量等级。
减量
首次剂量
增量
停药
每次40mg
每次50mg
停药每次40mg
每次50mg
每次60mg
停药每次40mg每次50mg
每次60mg
每次75mg
若需缩短化疗间期,须确认无本药所导致的实验室检查(血常规、肝肾功能)异常和胃肠道症状等安全性问题,但化疗间期不得少于7天。不能手术或复发性乳腺癌患者缩短化疗间期的安全性尚未得到证实(无临床用药经验)。
为避免骨髓抑制和暴发性肝炎等严重不良反应,每次化疗开始前须进行实验室检查(血常规和肝肾功能),全面观察患者的状况,化疗期间至少每2周进行1次检查。如发现任何异常,必须采取相应措施,如延长化疗间期、按上述规定减量或停药。第一治疗周期或增量时更须密切观察和检查(详见【临床试验】)。
基础研究(大鼠)发现空腹服药可改变奥替拉西钾的生物利用度,导致其对氟尿嘧啶磷酸化的抑制作用减弱,从而降低本药的抗肿瘤作用,故须餐后服用。
患者使用注意事项:
患者用药时应注意:
本药为铝塑泡罩包装(PTP),应告知患者服药前需将药物由泡罩中压出。曾有报道患者误将铝箔板服下,导致食道穿孔,引起严重并发症如纵膈炎。
药品相互作用
(1)药物合用的禁忌(本品不得与下列药物合用)(详见说明书表格)(2)合并用药注意事项(该产品与下列药物合用时需注意) (详见说明书表格)
特殊人群用药
孕妇及哺乳期妇女用药:妊娠或可能妊娠的妇女禁用替吉奥胶囊。[妊娠妇女服用UFT后曾发生新生儿畸形。另外,动物试验也曾发现致畸作用(妊娠大鼠和家兔连续口服替吉奥胶囊(相当于加氟7mg/kg和1.5mg/kg)发现胎儿内脏异常、骨骼异常和骨化延迟)]。 哺乳期妇女服用替吉奥胶囊时应停止哺乳[尚无临床资料,但动物(大鼠)试验发现替吉奥胶囊可经乳汁排泄]。(详见说明书)儿童用药:低体重出生儿、新生儿、婴儿、幼儿和儿童使用替吉奥胶囊的安全性尚未得到验证[尚无临床资料。如儿童必须使用替吉奥胶囊,须考虑其对性腺的影响,特别注意不良反应的发生]。老年用药:由于老年人的生理功能下降,须慎重使用本药。
不良反应
1. 国外临床试验:
联合治疗
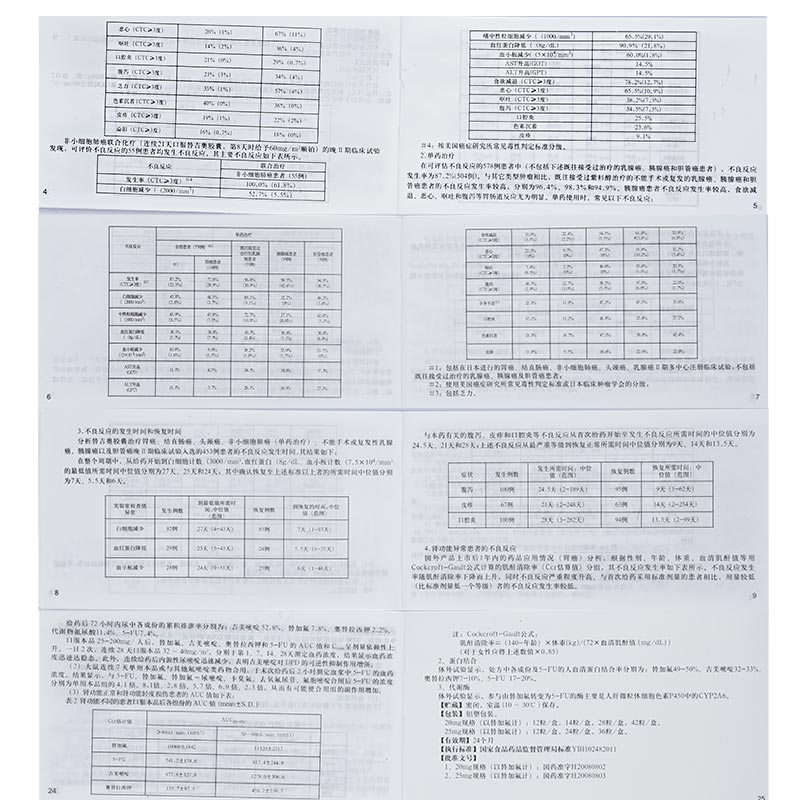
在日本进行的以晚期胃癌患者为对象、比较替吉奥腔囊单药(连续28天口服替吉奥胶囊40-60mg/次,每日2次,休息14天)和替吉奥胶囊联合顺铂(连续21天口服替吉奥胶囊40-60mg/次,每日2次,第8天时给予60mg/m2顺铂)治疗的多中心Ⅲ期随机对照试验,298例可评估不良反应的患者的主要不良反应如下表所示。
非小细胞肺癌联合化疗(连续21天口服替吉奥胶囊,第8天时给予60mg/m2顺铂)的晚Ⅱ期临床试验发现,可评价不良反应的55例患者均发生不良反应,其主要不良反应如下表所示。
(#)4:按美国癌症研究所常见毒性判定标准分级。
单药治疗
在可评估不良反应的578例患者中(不包括下述既往接受过治疗的乳腺癌,胰腺癌和胆管癌患者),不良反应发生率为87.2%(504例)。与其它类型肿瘤相比,既住接受过紫杉醇治疗的不能手术或复发的乳腺癌、乳腺癌和胆管癌患者的不良反应发生率较高,分别为96.4%、98.3%和94.9%。胰腺癌患者不良反应发生率较高,食欲减退、恶心、呕吐和腹泻等胃肠道反应尤为明显。单药使用时,常见以下不良反应:
(#1):包括在日本进行的胃癌、结直肠癌、非小细胞肺癌、头颈癌、乳腺癌Ⅱ期多中心注册临床试验,不包括既往接受过治疗的乳腺癌、胰腺癌及胆管癌患者;
(#2):使用美国癌症研究所常见毒性判定标准或日本临床肿瘤学会的分级;
(#3):包括乏力。
不良反应的发生时间和恢复时间
分析替吉奥腔囊治疗胃癌、结直肠癌、头颈癌、非小细胞肺癌(单药治疗)、不能手术或复发性乳腺癌、胰腺癌以及胆管癌晚Ⅱ期临床试验入选的453例患者的不良反应发生时间,其结果如下:
在整个周期中,从给药开始到白细胞计数3,血红蛋白4/mm3的最低值所需时间中位值分别为27天、25天和24天;其中确认恢复至上述标准以上者的所需时间中位值分别为7天、5.5天和6天。
与本药有关的腹泻、皮疹和口腔炎等不良反应从首次给药开始至发生不良反应所需时间的中位值分别为24.5天、21天和28天;上述不良反应从最严重等级到恢复正常所需时间中位值分别为9天、14天和13.5天。
肾功能异常患者的不良反应
国外产品上市后1年内的药品应用情况(胃癌)分析,根据性别、年龄,体重、血清肌酐值等用Cockcroft-Gault公式计算的肌酐清除率(Ccr估算值)分组,其不良反应发生率如下表所示。不良反应发生率随肌酐清除率下降而上升,同时不良反应严重程度升高。与首次给药采用标准剂量的患者相比,用量较低(比标准剂量低一个等级)者的不良反应发生率较低。
Cockcroft-Gault公式:
男性:Ccr=(140-年龄)体重(kg)/(72血清肌酐(mg/dL))
女性:Ccr=(140-年龄)体重(kg)0.85/(72血清肌酐(mg/dL))
重要不良反应
骨髓抑制、溶血性贫血:可能发生重度骨髓抑制如全血细胞减少、粒细胞减少(症状:发热、咽痛和全身不适)、白细胞减少、贫血及血小板减少(发生率如上)和溶血性贫血(发生率不明),须密切观察。如发现异常,应采取停药等必要措施。
弥散性血管内凝血(DIC):因可能出现DIC(0.4%),应密切注意患者状况。如血小板计数,血清FDP和血浆纤维蛋白原等血液学检查发现异常,须停药并采取必要措施。
暴发性肝炎等严重肝功能异常(发生率不明)(详见【警告】)。
脱水:可能因严重腹泻导致脱水(发生率不明),须密切观察。如发现异常,须停药并采取补液等相应措施。
重度肠炎:可能发生重度肠炎(0.5%),须密切观察。若发生严重腹痛、腹泻等症状,须停药并采取相应措施。
间质性肺炎*:可能发生间质性肺炎(0.3%) (早期症状:咳嗽、气短、呼吸困难和发热),须密切观察。如发现异常,须停药并进行胸部X光检查和给予肾上腺皮质激素等相应措施。
重度口腔炎、消化道溃疡、消化道出血和消化道穿孔:可能发生严重的口腔炎(发生率不明)、消化道溃疡(0.5%)、消化道出血(0.3%)和消化道穿孔(发生率不明),须密切观察。如发现异常,须停药,根据需要进行腹部x光等检查,并采取相应措施。
急性肾功能衰竭:可能发生严重的肾脏疾病如急性肾功能衰竭(发生率不明),须密切观察。如发现异常须停药并采取相应措施。
Steven-Johnson综合征和中毒性表皮坏死症(Lyell综合征):可能会发生Steven-Johnson综合征和中毒性表皮坏死症(发生率不明),须密切观察。如发现异常,须停药并采取相应措施。
脑白质病等神经精神系统异常:可能发生脑白质病(主要症状为意识障碍、小脑共济失调和痴呆样症状等)、意识障碍、定向力障碍、嗜睡、记忆减退、锥体外系症状,语言障碍、四肢瘫痪、步态障碍,尿失禁或感觉障碍(发生率均不明),应密切观察。若出现上述症状,须停药。
急性胰腺炎:可能出现急性胰腺炎(发生率不明),应密切观察。如果出现腹痛或血清淀粉酶升高,须停药并采取相应措施。
横纹肌溶解症:可能出现横纹肌溶解症(发生率不明),症状包括肌肉痛、虚弱、CK升高和血/尿叽红蛋白升高,须停药并采取相应措施,并注意防止横纹肌溶解所导致的急性肾功能衰竭。
嗅觉丧失:可能发生嗅觉障碍(0.1%)、嗅觉丧失(发生率不明),须密切观察。如发现异常,须停药并采取相应措施。
(*)对非小细胞肺癌患者进行了间质性肺炎和其他肺部疾病发生率的研究。
药物上市后在非小细胞肺癌的甩药研究表明间质性肺炎的发生率为0.7%(11/1669),其它肺部疾病包括放射性肺炎、呼吸困难和呼吸衰竭的发生率为0.7%(21/1669)。
其它不良反应
可能发生下列不良反应,如发现异常,须采取减量或停药等相应措施。如发现药物过敏,须停药并采取相应措施。既往接受过治疗的乳腺癌患者的手足综合征发生率较高(21.8%)。本药上市后临床研究发现,不能切除或复发的胃癌患者的溢泪发生率较高(16.0%)。
上述发生率根据本品获得批准前的单药临床试验结果计算。
不良反应注意事项
曾报告接受替吉奥胶囊治疗的患者出现急性白血病(个别病例伴随白血病前期)或骨髑增生异常综合征(MDS)。
有极少数患者缺乏氟尿嘧啶代谢酶-二氢嘧啶脱氢酶(DPD),若使用氟尿嘧啶类药物,则在给药初期可能出现严重不良反应(如口腔炎、腹泻、造血功能异常和神经系统疾病)。
曾发现脑梗死,但与替吉奥胶囊的因果关系并不确定。
奥替拉西钾在强酸环境下易分解(犬),而奥替拉西钾的浓度降低可减弱其抑制消化道不良反应的作用(大鼠),故胃pH值明星降低时有可能导致腹泻。
犬反复给药后曾发现球结膜巩膜色素沉着和角膜云翳。
2. 国内临床试验:
结果显示,与本品有关的不良反应发生率为83.78%,其中主要为血液系统68.47%(白细胞减少的发生率为45.05%,血小板减少的发生率为20.72%,多为Ⅰ、Ⅱ度下降),消化系统46.85%(恶心、呕吐39.64%、腹泻7.21%),其他14.41%。本品的血液系统不良反应与替加氟相当,但其消化道反应明显好于替加氟。
本品相关不良事件的发生率为2.70%,主要表现为轻度的胃肠道出血、红细胞降低,发生率低于替加氟(3.48%)。